本帖最后由 StarCare 于 2025-7-11 16:42 编辑
网址:
Safety and efficacy of oral DMSA therapy for children with autism spectrum disorders: Part A - Medical results | BMC Clinical Pharmacology | Full Text
口服 DMSA 治疗自闭症谱系障碍儿童的安全性和有效性:A 部分 - 医学结果- 詹姆斯·亚当斯,
- 马修·巴拉尔,
- 伊丽莎白·盖斯,
- 杰西卡·米切尔,
- 朱莉·英格拉姆,
- 安德里亚·亨斯利,
- 艾琳·扎皮亚,
- 桑福德纽马克,
- 伊娃·格恩,
- 罗伯特·鲁宾,
- 肯·米切尔,
- 杰夫·布拉德斯特里特 &
- 简·埃尔-达尔
36k 次访问 49 次引用 54 Altmetric
抽象背景本研究调查了口服二巯基琥珀酸 (DMSA) 疗法对 3-8 岁自闭症谱系障碍儿童的影响。 方法第 1 阶段涉及 65 名接受一轮 DMSA (3 天) 的儿童。选择有毒金属尿排泄量高的参与者继续进行第 2 阶段。在第 2 阶段,49 名参与者被随机分配到双盲设计中,接受额外的 6 轮 DMSA 或安慰剂。 结果DMSA 大大增加了铅的排泄,大大增加了锡和铋的排泄,并略微增加了铊、汞、锑和钨的排泄。必需矿物质(尤其是钾和铬)的尿液排泄有所增加。1 期单轮 DMSA 导致几乎所有病例的 RBC 谷胱甘肽显着正常化,并大大改善了异常血小板计数,表明炎症显着减少。 结论总体而言,DMSA 疗法似乎相当安全,可有效去除几种有毒金属(尤其是铅),对 RBC 谷胱甘肽正常化非常有效,对血小板计数正常有效。只有 1 轮 (3 天) 就足以改善谷胱甘肽和血小板。额外的子弹增加了有毒金属的排泄。
背景自闭症是一种严重的发育障碍,涉及社交退缩、沟通缺陷和刻板/重复行为。自闭症的原因尚不清楚,但遗传和环境因素都涉及其中。一个受到广泛关注的环境因素是汞和其他有毒金属对身体的负担。 重金属中毒可由高暴露或排泄重金属的能力降低引起,后一种情况似乎是自闭症的主要问题。从体内排泄汞和其他一些有毒金属的主要机制是与谷胱甘肽结合,然后通过胆汁排泄 [ 1]。婴儿特别容易受到金属中毒的影响,因为谷胱甘肽产量低,他们的排泄物很差[ 2],而且他们通常采用全奶饮食,在一项对大鼠的研究中,这减少了汞排泄的三倍[ 3]。 自闭症婴儿更容易受到汞和其他重金属的影响,因为他们的谷胱甘肽水平远低于正常儿童 [ 4-6],并且他们的谷胱甘肽被氧化的比例更高 [ 4, 5]。此外,四项研究发现,自闭症儿童口服抗生素的使用量远高于典型儿童 [ 7– 10]。口服抗生素的高使用率令人担忧,因为以前的大鼠研究发现,口服抗生素导致几乎完全丧失排泄汞的能力 [ 3, 11]。原因似乎是正常的肠道厌氧菌能够将甲基汞(被迅速吸收)转化为无机汞(吸收不良,因此大部分被排出体外)。相比之下,大多数酵母菌株和大肠杆菌进行相反的反应,即无机汞甲基化为甲基汞[ 12]。因此,大量口服抗生素会导致正常肠道菌群的丧失以及酵母和大肠杆菌的增加,从而导致甲基汞去甲基化的能力丧失和无机汞甲基化增加,最终导致排泄减少和汞吸收增加。 汞排泄能力下降与一项研究 [ 13] 一致,该研究发现,与正常婴儿相比,自闭症儿童婴儿头发中的汞含量仅为正常水平的 1/8,尽管两组对汞的主要来源(母体海鲜、汞牙科汞合金和疫苗中的硫柳汞)的暴露程度相似。自闭症的严重程度和头发中的汞水平也存在显着的负相关,表明排泄汞能力最弱的儿童出现最严重的症状。这些结果共同表明,排泄汞的能力下降,导致身体负担增加。一项重复研究 [ 10] 还发现,自闭症儿童婴儿头发中的汞含量往往低于典型婴儿。最近一项针对 1-5 岁儿童的研究 [ 14] 发现,自闭症儿童头发中的铅、镉和砷水平较低,表明排泄这些金属的能力下降;汞也有类似的趋势,但在那些年龄较大的儿童中没有统计学意义。 还有关于年龄较大的自闭症儿童头发和血液中汞含量的研究。这些研究的相关性有限,因为汞在血液中的半衰期只有几周,因此它们不能反映婴儿早期自闭症发展时的水平。美国的一项研究发现,血液中的汞和其他有毒金属水平升高 [ 6]。香港的一项研究发现,血液水平可能存在差异 (p = 0.056),但头发没有差异 [ 15]。然而,对他们的数据进行重新分析后发现,血液中的汞与头发中的汞比例异常,这表明存在排泄问题 [ 16]。美国的一项研究未发现年龄较大的自闭症儿童(3-15 岁)与对照组相比,头发中的汞含量有任何差异 [ 17]。 汞排泄能力下降会导致更高的身体负担,这在一项研究中得到了证明,该研究调查了与 18 名对照组相比,给 221 名自闭症儿童服用 DMSA(二巯基丁二酸)的效果 [ 18]。他们发现,自闭症儿童排泄到尿液中的汞是尿液(DMSA 排泄的地方)的 3.1 倍,p < 0.0002,但铅和镉水平没有显着差异。同样,一项小型研究 [ 9] 发现,与正常儿童相比,自闭症儿童的乳牙中的汞含量高出 2×。DMSA 激发试验可能是近期和较早暴露的量度,而乳牙是产前和婴儿暴露量的量度。 之前的一项研究 [ 8] 调查了自闭症儿童与对照组病史中可能影响重金属暴露的因素。发现自闭症谱系障碍 (ASD) 儿童 (n = 53) 与对照组 (n = 48) 的四种暴露在统计学上存在差异,包括较高的母亲海鲜消费量 (RI = 2.7,p = 0.02);较高的中耳炎相关抗生素使用量 (RI = 2.5,p = 0.0001);更多的吃/舔油漆 (p = 0.04) 和更多的异食癖 (30% 对 2%,p = 0.0002)。ASD 儿童对疫苗接种也有更直接的不良反应 (RI = 2.5,p = 0.002)。牙科病史没有显示重大差异,尽管有一种趋势表明,在 ASD 儿童的母亲中,在怀孕期间放置或去除汞填充物比对照组更常见 (RI = 7.0,p = 0.08)。 自 1999 年发现美国儿童疫苗中的硫柳汞含量远高于 FDA 和 EPA 指南以来,已经有许多流行病学研究关于含硫柳汞疫苗与自闭症之间的可能联系。一组的研究报告了显著的联系[ 19– 29],而其他研究组的5项研究未能建立这种联系[ 30– 34],1项研究尚无定论[ 35]。因此,自闭症与硫柳汞的联系仍然存在争议。 Bernard等[ 36]的一篇综述文章报道,婴儿自闭症的所有主要症状也常见于婴儿汞中毒,包括精神症状(语言缺陷、刻板行为、社交退缩)和身体症状(胃肠道问题、睡眠问题、肌张力低下和流涎过多)。Nelson 和 Bauman [ 37] 的一篇综述对 Bernard 等人 [ 36] 的论文提出了异议,并认为自闭症的症状和神经病理学与汞中毒不同。然而,美国有毒物质和疾病登记处 [ 38] 发布的汞毒理学概况指出,婴儿接触汞会导致神经损伤、智力低下、动作不协调、肌肉无力、癫痫发作和无法说话,这些症状与自闭症的症状相似。 一项研究 [ 39] 发现,与对照组 (n = 107) 相比,自闭症儿童 (n = 106) 的尿粪卟啉升高,这表明汞对血红素合成的影响。他们发现,在 DMSA 治疗几个月后,这些水平显着下降。两项较小的研究 [ 40, 41] 还发现,自闭症儿童的粪卟啉水平高于对照组,自闭症儿童的粪卟啉水平高于 PDD/NOS 或阿斯伯格症儿童。其中一项研究 [ 41] 还发现粪卟啉前水平升高。这两项研究都发现,接受螯合治疗的自闭症儿童粪卟啉水平升高较少。另一项研究 [ 42] 发现,汞相关卟啉(粪卟啉和前卟啉)的水平与儿童自闭症评定量表 (CARS) 评定的自闭症严重程度有显著相关性。最近的一份报告[ 43]发现,使用DMSA可以改善铅暴露动物的学习、注意力和唤醒调节。然而,同一篇论文还发现,高剂量 DMSA 给药可能会对未接触铅的大鼠造成持久的认知损伤,因此 DMSA 应仅在存在铅或类似有毒金属时使用。 总体而言,有大量研究表明,汞和其他有毒金属可能与某些自闭症病例的病因有关,尽管自闭症与硫柳汞的联系仍然存在争议。还有更普遍的证据表明,铅、汞和其他毒素会损害儿童发育,其水平与大多数美国人口相同[ 44]。有一些证据表明,使用 DMSA 疗法去除有毒金属可能有助于使卟啉-血红素通路正常化,并可能有助于改善自闭症的一些症状。 本文的目的是评价 DMSA 治疗对自闭症谱系障碍 (ASD) 儿童的安全性和有效性,重点是医疗效果。DMSA 对行为的影响将在以下论文中讨论 [ 45]。此外,这项研究发现自闭症的严重程度与尿液中有毒金属的排泄高度相关,结果在另一篇论文中报道[ 46]。DMSA 已获得 FDA 批准用于治疗 2 岁儿童的铅中毒,本研究调查了其在超说明书应用中的用途,即治疗有大量重金属暴露证据的 ASD 儿童(基于 DMSA 激发后的尿液排泄)。DMSA 优先与铅结合,但也可以在较小程度上增加其他几种有毒金属(包括汞)的排泄。其他试剂,如 DMPS,对汞具有更强的亲和力,但它们未获得 FDA 批准用于人类,因此决定开始使用 DMSA 进行初步解毒研究。 本研究的具体目标包括: 1) 评估 DMSA 治疗对 ASD 患儿的影响,包括对有毒金属排泄、必需矿物质排泄、谷胱甘肽水平、血液化学、全血细胞计数 (CBC) 和自闭症症状的影响。 2) 调查自闭症严重程度与尿液中有毒金属的排泄和谷胱甘肽初始水平之间的可能相关性。
方法该研究设计为在第 1 阶段进行一轮筛选(3 天内 9 剂)DMSA,然后进行额外 6 轮的随机、双盲、安慰剂对照研究(见图 1)。筛选轮的目的是只允许有毒金属排泄量高的参与者进入第 2 阶段。然而,如下所述,DMSA 的单轮筛选对改善异常的谷胱甘肽和血小板水平产生了意想不到的巨大影响,并且这种影响一直持续到第 2 阶段结束,因此第 2 阶段不是安慰剂对照研究。相反,最好将这项研究解释为 1 轮 DMSA(和 6 轮安慰剂)与 7 轮 DMSA 的效果比较。在下面讨论这两个组时,我们将它们称为“1 轮”组和“7 轮”组。 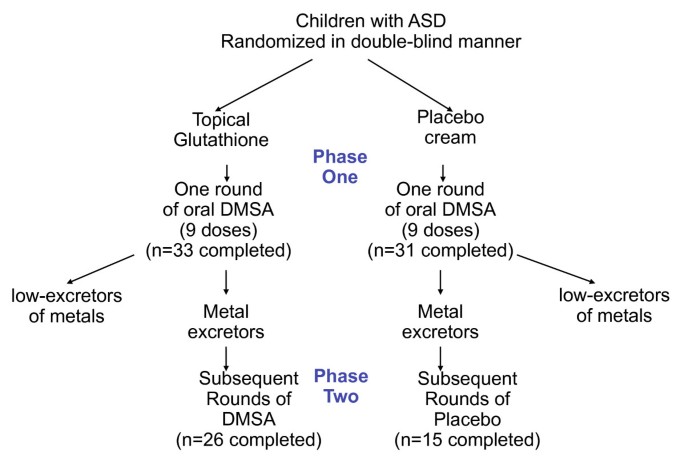
研究设计。两组参与者都接受了一轮口服 DMSA 挑战;那些排泄大量重金属的药物继续进入第 2 阶段,并额外接受了 6 轮额外的 DMSA 或安慰剂。
参与者选择这项研究是在西南自然疗法医学院人类受试者机构审查委员会的批准下进行的。所有父母和(在可能的情况下)儿童都签署了知情同意书/同意书。 第一阶段的标准是: 1) 由精神科医生、心理学家或发育儿科医生诊断的自闭症谱系障碍儿童 2) 年龄 3-8 岁 3) 无汞合金牙科填充物 4) 以前没有使用过 DMSA 或其他处方螯合剂 5) 没有贫血或目前正在接受低铁贫血治疗。 6) 对 DMSA 无已知过敏 7) 无肝或肾病 8) 儿童水分充足(每天摄入足够的水) 第二阶段的标准是: 表 1 给出了参与者的特征。所有参与者都是亚利桑那州居民。 1) 每个孩子首先接受身体检查,以确定他/她的健康状况足以参加研究。 2) 进行抽血以检测血液化学 (包括肾和肝功能) 和全血细胞计数 (CBC) 以及红细胞 (RBC) 谷胱甘肽。如果肝肾功能正常且 FBC 不低于正常范围,则孩子有资格参加第 1 阶段。 3) 每位家长都填写了一份初始自闭症治疗评估清单 (ATEC) 问卷和重金属暴露问卷。 4) 父母收集了基线第一早上的尿液样本。 5) 父母开始每天服用含有谷胱甘肽或安慰剂的化妆水,以随机、双盲的方式给药。每天 1× 次给药,沐浴后在干净的皮肤上,孩子擦在上面。对一半的儿童服用谷胱甘肽,看看它是否影响他们有毒金属的排泄和有毒金属的水平。 6) 服用“谷胱甘肽”化妆水 7 天后,所有儿童均接受口服 DMSA。剂量为 10 mg/kg 剂量,3×/天,持续 3 天。DMSA 由 Spectrum Chemical 提供的药用级 DMSA(纯度超过 99%)为每个孩子单独配制。父母在第一次给药后约 8 小时和第 9 次给药后约 8 小时内收集所有尿液。鼓励儿童在服用 1圣和 9th剂量,但不需要依从性。 7) 将尿液样本冷冻并运送到 Doctor's Data Laboratories(伊利诺伊州圣查尔斯)以测量有毒和必需矿物质的排泄。有毒金属排泄量高的儿童(武断定义为高于医生数据参考范围,定义为未接受螯合治疗的典型儿童的前 95%)被允许继续进入第 2 阶段。请注意,这个级别有点武断,选择这个级别是为了让只有排泄大量有毒金属的儿童才能进入第二阶段。 第二阶段1) 在第 2 阶段开始时重新测量血液化学、 CBC 和 RBC 谷胱甘肽。如果肝肾功能正常,如果 FBC 不低,并且在第一阶段有大量金属排泄,则选择儿童继续进入第二阶段 2) 由 ADOS 认证的评估员进行自闭症诊断观察表 (ADOS) 检查(大约 1 小时的评估),以进一步描述参与者的特征。每个孩子在开始和结束时总是由同一个评估员进行检查。根据沟通 + 社交分数的总和,在接受评估并完成研究的 41 名参与者中,81% 符合自闭症标准,12% 符合自闭症标准,7% 不符合 ASD 标准。所有儿童都继续进行研究,因为他们之前都有过 ASD 的临床诊断。 3) 家长填写了两份关于自闭症严重程度的问卷,即普遍性发育障碍 - 行为量表 (PDD-BI) 和自闭症严重程度量表 (SAS)。 4) 儿童接受 DMSA 或安慰剂,并服用最多 3 轮。每轮包括 3 天的 DMSA/安慰剂(与第 1 阶段一样),然后是 11 天的无 DMSA/安慰剂。最初接受谷胱甘肽化妆水的儿童接受 DMSA,接受安慰剂“谷胱甘肽”化妆水的儿童接受安慰剂“DMSA”。在研究的第二阶段,这些家庭继续被设盲。该设计导致一组儿童接受局部谷胱甘肽和口服 DMSA 激发,然后继续给予 DMSA,第二组参与者接受单轮 DMSA 激发,没有局部谷胱甘肽,随后没有接受任何进一步的螯合治疗。 5) 9 次th2 结束时 DMSA(或安慰剂)的剂量ND第 2 阶段的回合。这被运送到 Doctor's Data 进行测试。 6) 在 3RD在第 2 阶段进行一轮 DMSA(或安慰剂),再次测量血液化学和 CBC。如果儿童的肾/肝功能正常且 FBC 正常,并且根据 2ND一轮测试,他们又接受了 3 轮 DMSA/安慰剂。 7) 在 6th第 2 阶段的 DMSA 轮次,测量最终的血液化学和 FBC。 8) 当参与者完成第 2 阶段(3 轮或 6 轮后)时,由进行第一次评估的同一评估员进行 ADOS 评估。家长再次填写了 ATEC、SAS 和 PDD-BI,以及家长总体印象问卷。再次要求与孩子合作的专业人员为孩子填写 ATEC 表格。 DMSA 的剂量口服 DMSA 的剂量为每剂 10 mg/kg,每天 3 剂。这是医师案头参考 (PDR) 中推荐的剂量,也是我们在之前的 9 剂研究中使用的剂量 [ 18]。 安慰剂是甲基纤维素,一种通常用作填充剂的惰性材料。它包装在与 DMSA 相同的药丸和瓶子中。由于 DMSA 具有强烈的气味,因此每个瓶子都包含一个装有 DMSA 的小开槽容器,因此容器中存在药物气味。 谷胱甘肽的剂量谷胱甘肽的每日局部剂量约为 180 毫克还原型 l-谷胱甘肽,溶于肉豆蔻酸异丙酯、矿物油、辛酸/癸酸三格列草酯和维生素 E 乙酸酯的化妆水中。安慰剂在包装和配方上相同,只是不含谷胱甘肽。 生化检查和全血细胞计数 (CBC)由 Quest Laboratories 测量。 尿液检测使用电感耦合等离子体质谱法通过医生数据测量有毒和必需矿物质,并使用 Jaffe 方法测量肌酐。实验室对治疗组和安慰剂组不知情。 红细胞 (RBC) 谷胱甘肽全血中的大多数谷胱甘肽存在于红细胞中。红细胞谷胱甘肽由免疫科学实验室使用 Oxis Research(加利福尼亚州福斯特城)提供的试剂盒进行测量。该方法基于发色硫酮的形成。在 405 nm 处测得的吸光度与 GSH 浓度成正比。 统计分析根据所解决的研究问题,使用了几种类型的统计分析。获得 Pearson 相关系数以确定分析中涉及的变量之间线性关系的强度。在比较组内前后水平(例如尿金属排泄的变化或参与者自闭症严重程度的变化)时,使用了 2 侧配对 t 检验,对于每个单独的假设,假设 p 值为 0.05 或更低对于个体分析是显着的。但是,当考虑多重比较时,则使用 Bonferroni 校正。 由于这项研究主要是探索性的,我们检查了几个测量量之间的关系,例如各种自闭症严重程度测量的变化与第 1 阶段 DMSA 首次给药后有毒金属排泄水平变化之间的关系,或初始谷胱甘肽水平与初始有毒金属排泄水平之间的关系在第 1 阶段给予第一剂 DMSA 之前受试者。对于选定的因变量和自变量,进行了逐步线性回归分析;在每个步骤中,消除具有最高 p 值的变量,并持续此过程,直到调整后的 R2价值开始下降。因此,目标是确定所选模型最适合数据库的模型,同时考虑自变量之间的相关性。由于数据库有一些缺失值(由于缺少实验室或行为数据),回归分析以两种略有不同的方式进行,通常产生非常相似的结果:1) 在分析开始时消除模型中任何变量数据缺失的所有参与者,以及 2) 根据需要消除参与者(即 仅当分析的当前步骤中任何变量存在缺失数据时)。由于这两种方法通常产生非常相似的结果,因此我们通常只报告方法 1 的结果。唯一的例外是 ADOS 的变化,在这种情况下,我们报告两种方法的结果。 参与第一阶段参与我们从 82 名参与者开始,以滚动方式入组。77 人完成了初次抽血,65 人完成了第一阶段的抽血。在最初的 82 人中: 由于肝酶升高,一项不符合研究资格。四人在体检后停止了。11 例在初次抽血后停止(在 2 例中,这是由于难以收集尿液样本)。一名参与者服用了 DMSA 并收集了尿液样本,但由于缺乏兴趣/时间而没有将其送到实验室。 参与者过渡到第 2 阶段和不良事件在完成第一阶段的 65 名儿童中,有 49 名继续进入第二阶段。9 名儿童不允许继续进入第 2 阶段;在 8 例中,这是由于有毒金属的低尿液排泄,在 1 例中,这是由于极高的铅排泄(在基线和 DMSA 后)。(该患者被转介给他们的初级保健医生进行随访,以评估急性铅暴露)。另有 7 个家庭因与研究无关的个人原因没有继续。 最后,在 I 期有一例轻度不良反应 (嗜睡、食欲下降),该家庭决定不继续进入 2 期。 第 2 阶段参与49 例患儿开始第 2 期,41 例完成 (其中治疗组 5 例因尿毒性金属排泄量低而提前结束 2 期ND第 2 阶段的 DMSA 回合。 1 例因精神科药物治疗导致肝酶升高而停药。 1 因家人去世而掉落 2 例由于被认为缺乏益处而下降 - 1 例服用安慰剂,1 例服用 DMSA。 4 因不良反应而掉落: 睡眠问题(DMSA 上) 行为和一些技能恶化(在 DMSA 上) 行为恶化,更多的自我刺激行为 - (服用安慰剂) 行为恶化,一些倒退(安慰剂组) 在大多数情况下,不良症状是暂时的,并在停止治疗后一周内消退。在一个接受 DMSA 的儿童案例中,孩子有获得和失去技能的历史,父母认为孩子在学习期间确实永久性地失去了一些技能。然而,从研究开始到结束,该孩子的 ADOS 分数要么没有变化(沟通、社交能力)要么有所提高(游戏:2 比 1,刺激行为/兴趣受限:4 比 2)。 5 名参与者完成了第 2 阶段第 2 轮,但他们的有毒金属尿液排泄量已降至我们的临界值以下,因此没有资格继续进入第 2 阶段的其余部分;因此,他们在第 1 阶段接受了 1 轮 DMSA,在第 2 阶段接受了 2-3 轮 DMSA 后完成了研究。
结果尿液排泄 - 有毒金属一名参与者的结果被排除在本节和其他地方的一般分析之外,因为她在基线和服用 DMSA 后的许多有毒金属水平都非常高,包括极高的基线铝(其他参与者的平均水平 63×)、锑(平均 45×)、铋(平均 40×)、镉(平均 7×)、铅(平均 12×)、锡(平均 12×)和铀(平均 65×)。DMSA 后,她的锑排泄量增加到基线 (1000× 基线的 24×铅增加到基线的 2.4× 其他金属的排泄量受到的影响较小。该参与者没有继续进入第 2 阶段,以便她可以进行私人治疗。 对于所有其他参与者,表 2 和图 2a 显示了基线(第 1 阶段开始,服用任何 DMSA 之前)以及第一次和第 9 次之后的有毒金属尿排泄水平(每克肌酐标准化)th第 1 阶段挑战轮中的 DMSA 剂量。金属按 DMSA 对排泄的影响顺序列出。铅排泄量增加非常大且具有极高统计学意义。锡和铋的排泄也大幅而显着地增加。铀排泄量大幅增加,但无统计学意义(只有 14-15 名参与者在服用 DMSA 之前或之后可检测到铀排泄)。汞排泄的初始增加幅度很大且非常显著,但在 9th剂量 排泄量仅略高于基线,无统计学意义。铊、锑和钨的排泄显着增加。铝或镉的含量变化不大。镍排泄的初始略有减少,砷的排泄在 9th仅剂量。由于多重比较(12 种金属),只有低于 0.004 的 p 值应被视为显著性,而 0.05 至 0.004 之间的 p 值应被视为微不足道。 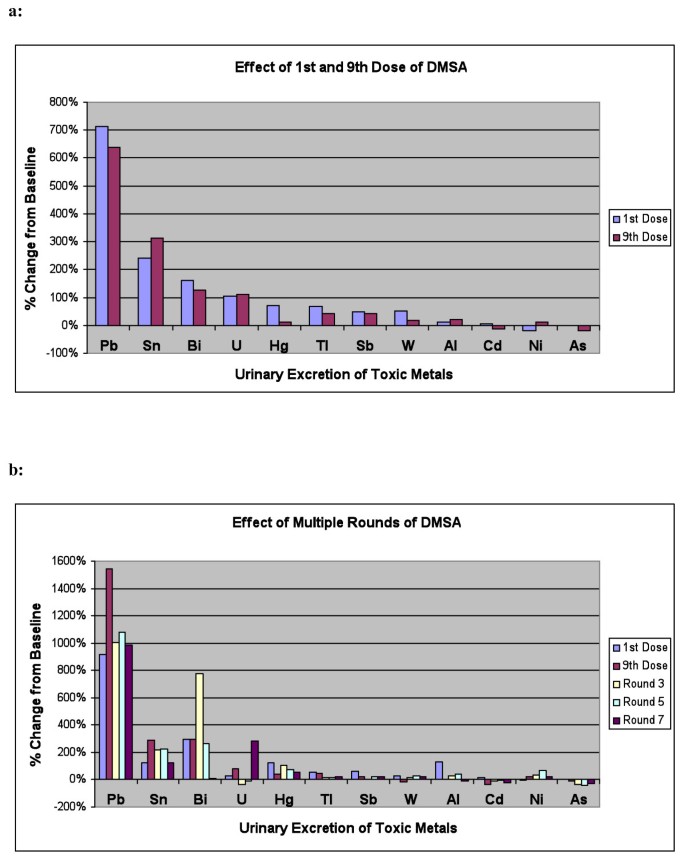
有毒金属尿液排泄的百分比变化。a:1 后有毒金属排泄量的百分比变化圣和 9th第 1 阶段 DMSA 的剂量。(n = 63) 中。b:1 后有毒金属尿排泄的百分比变化圣和 9th第 1 轮的剂量,然后是第 9 轮th第 3、5 和 7 轮剂量,适用于接受 7 轮 DMSA 的组。(n = 20) 的
[size=0.875][size=0.875]全尺寸图像
通过比较接受 DMSA + 谷胱甘肽化妆水与 DMSA + 安慰剂化妆水的组,分析谷胱甘肽化妆水对有毒金属排泄的影响。一般来说,在比较第 1 剂后加上第 9 剂后的平均排泄量与基线时,两组没有统计学意义差异。然而,接受 DMSA + 谷胱甘肽的组的汞排泄量可能更高 (p = 0.06)(平均排泄量分别为 1.38 和 0.91,基线分别为 0.73 和 0.80,以 mcg/g 肌酐为单位)。 表 3 和图 2b 显示了第 2 阶段治疗组参与者的有毒金属尿液排泄数据 (n = 20)。下表列出了他们的第 1 阶段结果(1圣和 9th剂量)及其 2 期结果(在 2 期 DMSA 的第 2、4 和 6 轮之后)。为方便起见,表 3 按与表 2 相同的顺序列出了金属。请注意,该组中的参与者人数小于表 2 中的参与者人数(分别为 n = 20 和 n = 63),这会影响哪些结果具有统计意义。一般来说,第 2 阶段的结果与第 1 阶段的结果相似。总体而言,铅的排泄量非常大,锡、铋、汞和铊的排泄量有所增加,铀、锑、钨、镍的排泄量可能增加,镉和砷的排泄量减少。铅排泄的增加贯穿整个研究过程,汞排泄通常也持续存在一些波动。
表 4 列出了基线时尿金属排泄量彼此之间的相关性,表 5 列出了 9 时的相关性th第 1 阶段的剂量,表 6 列出了 9 的相关性th剂量与基线。大多数金属与其他金属具有一个或多个显著相关性,因此回归分析很难区分一种金属与另一种金属的影响。由于进行了多次比较,因此仅列出了小于 0.01 的 p 值。
必需矿物质和其他矿物质的尿液排泄表 7 和图 3 显示了第 1 阶段必需金属和其他金属的平均尿液排泄量,包括基线值以及第 1 阶段后的百分比变化圣DMSA 的剂量和 9th第 1 阶段的 DMSA 剂量。铜、钾和锰的排泄量大且具有统计学意义。铁排泄增加,且略有统计学意义。钒、铬、钠和硼的排泄最初有适度的增加,但随后它们与 9 的基线相似th剂量。锌和镁的排泄量最初与基线相似,然后在 9th剂量。锆和锂的平均增加幅度很大(由于一些异常值),但增加没有统计学意义。钡、硫、硒、钴、钙、锶和磷的排泄不受显著影响。钼的排泄量在 9th剂量,但意义不大。由于进行了多次比较,因此只有低于 0.003 的 p 值才应被视为显著。 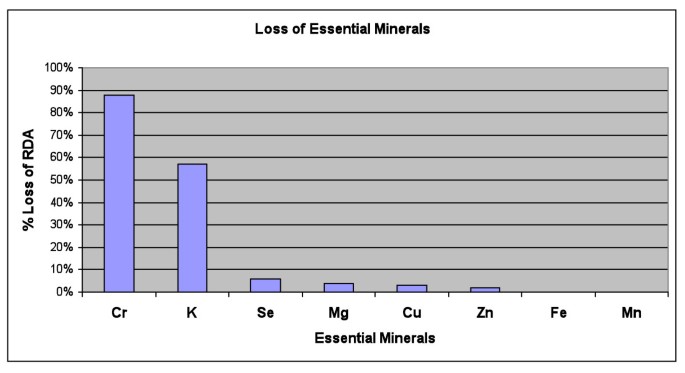
必需矿物质的损失,第 1 阶段 DMSA 治疗 3 天的平均损失,以 % RDA 为单位。唯一的主要损失是铬和钾。
[size=0.875][size=0.875]全尺寸图像
表 7 还列出了必需矿物质的额外损失,以每天推荐每日摄入量 (RDA) 损失的比例计算,基于两个合理的假设:1) 将 1 之间的损失平均圣和 9th剂量,以及 2) 假设每天尿液排泄 500 微克肌酐,这是 60 磅儿童的典型特征。在此基础上,铬(占 RDA 的 88%)和钾(占 RDA 的 57%)每天损失很大。其他必需矿物质的损失量可以忽略不计(不到 RDA 的 6%)。 应该注意的是,所有参与者在研究之前和整个研究期间至少服用了两个月维生素/矿物质补充剂,以尽量减少由于必需矿物质可能损失而产生的影响。 RBC 谷胱甘肽在基线和第 2 阶段开始时(对于那些继续进入第 2 阶段的人)测量红细胞 (RBC) 中谷胱甘肽的水平,通常是服用 DMSA 后 1.5 个月(42 天 +/- 33)。这些值在表 8 和图 4 中给出。最初,水平分布非常广泛,有些水平低于或高于实验室对成人的参考范围,定义为平均值周围 +/- 2 个标准差。(应该注意的是,儿童的水平往往低于成人,但实验室没有儿科参考范围。DMSA 给药后,平均水平变化不大 (小幅下降,无统计学意义),但标准差显着变小。图 4c 绘制了谷胱甘肽与初始水平的平均变化。谷胱甘肽水平的变化与初始谷胱甘肽具有极高的负相关 (-0.96,p < 0.0001)。具体而言,初始水平异常低的儿童谷胱甘肽向平均值大幅增加,初始水平异常高的儿童向平均值大幅下降,初始平均值的儿童变化不大。请注意,无论参与者是接受谷胱甘肽化妆水还是安慰剂化妆水,这种变化都非常相似,这表明这种效果是由于 DMSA 造成的。 
RBC 葡萄糖硫酮分布。a:初始 RBC 谷胱甘肽分布(预处理)。许多自闭症儿童的水平低于和高于实验室的 427-714 微磨牙参考范围。每个直方图对应于该值与其下方 50 之间的频率;即,标记为 “50” 的直方图是从 0 到 50 的值的频率。b:第一轮(3 天)DMSA 后 1-2 个月的 RBC 谷胱甘肽分布。分布急剧收紧,因此大多数儿童处于实验室对典型成人的参考范围内。c:第一轮 DMSA 后 1-2 个月红细胞谷胱甘肽的变化。最初水平低的儿童谷胱甘肽水平大幅增加,水平高的儿童谷胱甘肽水平大幅下降,因此大多数谷胱甘肽水平正常化。黑点是接受 DMSA 和谷胱甘肽化妆水的参与者,红点是接受 DMSA 和安慰剂化妆水的参与者。两组的趋势线直接位于彼此的顶部,表明与 DMSA 的效果相比,谷胱甘肽化妆水的效果可以忽略不计。
[size=0.875][size=0.875]全尺寸图像
RBC 谷胱甘肽和重金属相关性分析发现,基线 RBC 谷胱甘肽 (DMSA 前) 与几种金属的尿排泄呈显著正相关 (基线时和 9 后thDMSA 的剂量),包括基线 Sb (r = 0.26) 和第 9 剂后尿中 Pb (r = 0.25)、Al-9 (r = 0.29) 和 Cd (r = 0.30) 的排泄,表明这些金属水平的增加与 RBC 谷胱甘肽的增加相关。这表明身体通过增加红细胞谷胱甘肽的产生来应对大多数有毒金属水平的增加。然而,红细胞谷胱甘肽与第 9 剂汞的排泄呈负相关 (r = -0.27),这表明汞对红细胞谷胱甘肽有不利影响,可能是由于在谷胱甘肽与汞结合后导致其从体内排出,也许更重要的是通过抑制谷胱甘肽的产生。非常有趣的是,汞(仅汞)与 RBC 谷胱甘肽呈显著的负相关,这再次表明了汞的特殊重要性和毒性。 根据基线时和 9 点后有毒金属的尿液排泄量进行预测初始谷胱甘肽的逐步线性回归分析thDMSA 的剂量。结果如表 9 所示。发现初始谷胱甘肽可以部分预测(校正后的 R2= 0.25,p = 0.003),主要基于镉、铅、锡、铊和砷的排泄。
对基线和第一轮 DMSA 后谷胱甘肽的变化进行了类似的分析,发现谷胱甘肽的变化可以部分预测(调整后的 R2 = 0.29, p = 0.002) based primarily on excretion of cadmium after the 9th dose in phase 1 (see Table 9). This is consistent with the correlation analysis above. 表 10 显示了 77 名参与者在接受任何治疗前的初始全血细胞计数结果。初次抽血时唯一有点不寻常的特征是 18% 的血小板升高(参考范围为 130-450 k/mm3),这是炎症的标志物。淋巴细胞百分比往往略高于或低于参考范围,但绝对淋巴细胞几乎都在参考范围内。
表 11 显示了在第一轮 DMSA 之前和之后 1.5 个月(42 +/- 33 天)测量的全血细胞计数 (CBC) 的变化。唯一的显着变化是血小板计数减少 6% (p = 0.02)。血小板计数的下降主要发生在初始水平高于参考范围(减少 70 k/mm)的组中3),而最初在参考范围内的组的变化要小得多(减少 24 k/mm)3),1 例最初水平偏低的儿童增加 26 k/mm3的相关性。初始血小板水平,变化为 -0.32,p = 0.05。图 5a 显示了血小板计数的初始分布,图 5b 显示了第一轮 DMSA 后 1-2 个月的值,图 5c 显示了两组第 2 阶段结束时的值。总体而言,许多最初水平较高的儿童向正常范围下降,而 1 名初始值较低的儿童向正常范围增加。有趣的是,一个孩子的初始值非常高,为 1996 k/mm3,到研究结束时下降到 1195 k/mm3.
图 5 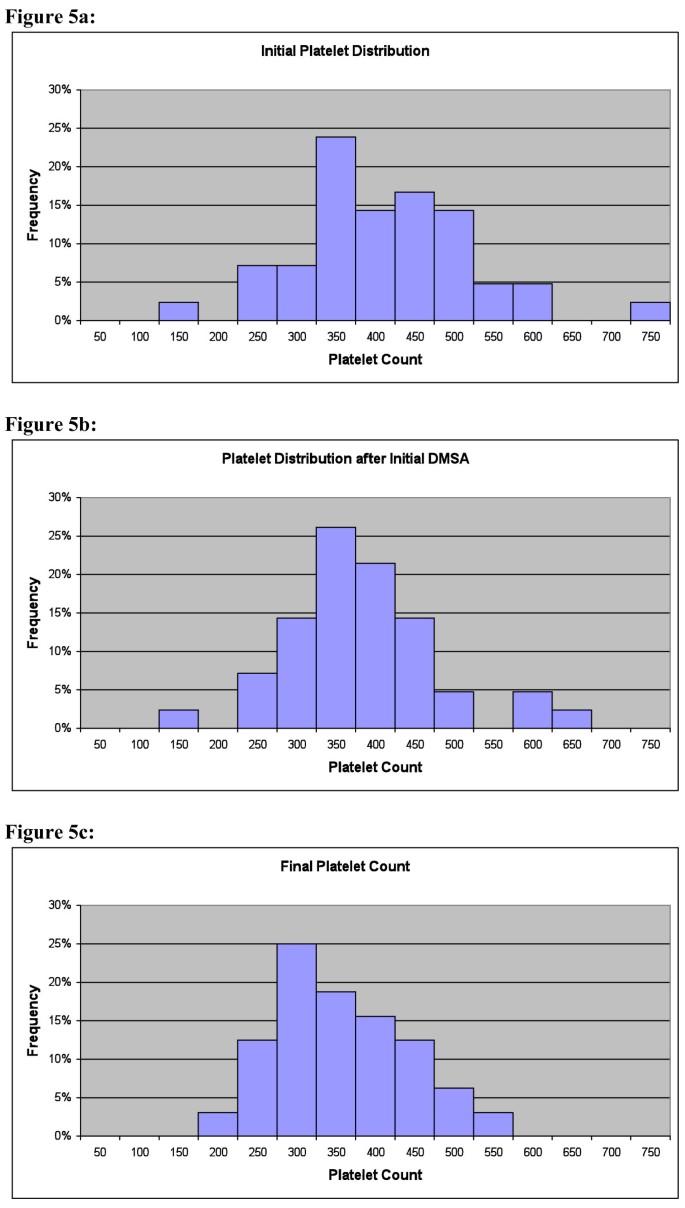
血小板计数。a:DMSA 前的血小板计数。请注意,许多子项的值高于参考范围 (130-450 k/mm)3).1 个孩子的 1996 k/mm3),该图表未显示在此图表中。b:第一轮 DMSA 后 1-2 个月的血小板计数。DMSA 的主要作用是减少升高的血小板,对正常或低范围内的血小板影响不大。1 个子项的 1917 k/mm 仍然具有非常高的值 (1917 k/mm3),该图表未显示在此图表中。c:研究结束时的血小板计数。由于结果相似,因此将 7 轮组和 1 轮组绘制在一起,尽管 7 轮组的减少幅度略大于 1 轮组。DMSA 的主要作用是使升高的或(在一种情况下)低的血小板正常化。一个子项的 1195 k/mm 仍具有较高的值3虽然没有显示出来,但与最初的 1996 k/mm 相比已大幅下降3).
由于担心 DMSA 可能对白细胞计数产生影响,因此仔细调查了白细胞计数。对于 7 轮组,白细胞计数下降了 7%(不显著),1 名儿童最初水平较高,最后 1 名儿童水平较高,1 名儿童结束时水平略低于参考范围(3.9 k/mm)3,与 4.0-12.0 k/mm 的参考范围相比3).以略低的水平结束的儿童开始时的水平为 4.9 k/mm3;在第 2 阶段开始时为 3.6,然后在研究中期为 5.2 K/mm3,因此在研究期间,总白细胞计数在参考范围的底部附近波动,但参与者在任何时候都没有出现中性粒细胞减少或淋巴细胞减少。对于第 1 轮组,白细胞计数减少了 8% (不显着),其中一名儿童最初水平升高,并且在研究结束时全部正常。 初始血小板计数的逐步线性回归分析未显示与尿液中有毒金属排泄有任何显着关系(在基线和 9th剂量)和初始谷胱甘肽。然而,对从第 1 阶段开始到第 2 阶段开始时血小板计数的变化进行了类似的分析,在 9 之后排泄有毒金属thDMSA 的剂量和谷胱甘肽的变化作为因变量。发现血小板计数的变化可以部分解释(校正后的 R2= 0.41,p = 0.02),主要因素是 Tl (p = 0.002)、As (p = 0.01)、Cd (p = 0.03) 和谷胱甘肽的变化 (p = 0.04)。表 12
化学面板表 10 显示了第 1 阶段 77 名参与者 的初始血液化学组的结果。主要的不寻常特征是异常高的血尿素氮 (BUN)/肌酐比率,这是肾功能的指标。最初,43% 的儿童的值高于实验室的参考范围,没有儿童的水平低于参考范围。这主要是由于血清肌酐水平低 (22% 的儿童水平低于参考范围,没有人的水平高于参考范围)。BUN 值几乎都在参考范围内,但往往处于参考范围的高端。 表 11 还显示了在第一轮 DMSA 之前和之后 1.5 个月(42 +/- 33 天)测量的血液化学 变化。血液化学没有统计学意义的变化。然而,有趣的是,最初 17/42 参与者的血尿素氮 (BUN)/肌酐比率升高,而在 DMSA 之后下降了 6%(不显着),因此只有 14/42 的参与者水平升高,1/42 的参与者水平较低。初始比值升高的原因主要是由于肌酐低(8/42 名儿童),而没有儿童的初始 BUN 值高。低肌酐定义为小于 0.4 (年轻) 或 0.5 (老) mg/dl。总体而言,这表明肾功能没有恶化。 逐步线性回归分析发现,初始 BUN/肌酐比值的变化可以通过基线时和 9 点后的尿金属排泄来部分预测th第 1 阶段的剂量,调整后的 R2= 0.35,p = 0.0001,最显着的因素是基线 Sn (p = 0.003)、基线 W (p = 0.02) 和 9th剂量 Sb (p = 0.05)。 类似的分析发现,从第 1 阶段开始到第 2 阶段开始时 BUN/肌酐的变化可以部分预测(调整后的 R2= 0.51,p = 0.05,最显著因子为 9th剂量 Hg (p = 0.01),谷胱甘肽的变化 (p = 0.02),9th剂量 Tl (p = 0.04) 和 9th剂量 Pb (p = 0.05)。 在第 2 阶段结束时,7 轮治疗组的血液化学没有任何显着变化。嗜酸性粒细胞可能有小幅下降的趋势 (-18%,p = 0.08),最初为 3/21 高,研究结束时仅为 2/21 高。甘油三酯也有可能增加的趋势 (+47%,p = 0.06) - 最初都是正常的,在研究结束时 2/21 升高。相比之下,在 1 轮治疗组中,甘油三酯水平降低了 15%(不显着)。应该注意的是,这些不是空腹测量,因此波动可能与饮食有关。 有趣的是,碱性磷酸酶增加了 12%(不显着),最初 0/42 的水平异常,5/42 的水平在研究结束时升高。碱性磷酸酶升高与生长突增有关,预计研究年龄范围内的儿童通常会有生长突增。 重金属暴露问卷表 13 列出了父母报告的与有毒金属暴露相关的病史数据。分析了其中一些因素以确定它们是否与自闭症的严重程度相关。出生后前 3 年的母体鱼消费量(汞的主要来源)和口服抗生素总量(抑制汞的排泄)与基线时的任何自闭症严重程度量表均无显著相关性。母体汞合金填充物的数量与 SAS、PDD-BI 自闭症量表或 ADOS 总数无关,但 ATEC 总数与母体汞牙齿填充物呈负相关 (-0.33) - 这是出乎意料的,因为它表明较高的汞填充物数量与不太严重的自闭症相关。 表 14 显示了 “吃/舔油漆 ”和异食癖与自闭症严重程度评分和金属排泄的强相关性。应该注意的是,自闭症严重程度量表和金属排泄的相关性评分通常非常相似。
尿液排泄 - 有毒金属DMSA 大大增加了铅的排泄,这并不奇怪,因为它已被 FDA 批准用于治疗铅中毒。锡和铋(毒性较小)也大幅增加,汞、铊、锑和钨有所增加,铀和(在以后的几轮中)镍可能增加。通常对镉、砷或铝几乎没有影响。 只有 20% 的儿童在第 2 阶段的第 3 轮后停止了治疗,因为尿液排泄量减少低于我们选择的标准。在 80% 的情况下,即使在第 2 阶段的第 6 轮结束时,铅的排泄水平仍然很高,这表明需要更多的轮次。在设计这项研究时,尚不清楚治疗多长时间,这些数据表明大多数儿童需要更长的治疗时间才能进一步降低铅和其他有毒金属的水平。其他药物,例如 DMPS,在去除汞方面会更有效。如果存在,似乎需要其他药物来治疗镉、砷或铝中毒。 将这项研究的结果与 Bradstreet 等人 2003 年的研究进行比较很有趣,因为在第 1 阶段我们复制了他们的剂量(3 天内 9 剂,10 mg/kg 剂量)。在那项研究中,他们没有测量基线尿排泄量,但他们确实测量了 9 轮 DMSA 后的尿排泄量,剂量与我们使用的剂量相同。他们报告说,在 9 轮 DMSA 后铅排泄量较高(18.2 +/- 43.3 vs. 9.2 +/- 7.8 mcg/g-肌酐)。他们发现汞排泄量要高得多(6.4 +/- 13 对 0.97 +/- 0.88 微克/克肌酐)和镉排泄量略高(0.48 +/- 0.42 对 0.33 +/- 0.23)。在两项研究中,样本的收集方式相似,并且测量由同一实验室完成,因此不太可能出现采集或测量错误。相反,Bradstreet 等人研究中的人群似乎具有更高的铅、汞和镉身体负担,可能是因为他们年龄稍大(6.2 岁,范围 3 至 15 岁),或者更有可能是因为他们来自该国的不同地区(美国与亚利桑那州)。与美国其他大部分地区不同,亚利桑那州在过去几十年中人口增长异常迅速,从 1970 年人口普查的 270 万增加到 2006 年的估计 610 万。因此,亚利桑那州的含铅涂料和含铅汽油的使用量比美国其他地区少得多,这可能解释了这项研究与布拉德斯特里特研究之间铅含量的差异。由于饮食(海鲜)和环境暴露的地理差异,本研究和 Bradstreet 的研究之间的汞含量差异可能具有相似的来源。因此,在比较不同研究的有毒金属暴露时,考虑地理影响非常重要。 必需矿物质的尿液排泄根据我们的测量,DMSA 确实对几种必需矿物质的尿液排泄有显着影响。然而,在大多数情况下,损失金额只是 RDA 的一小部分(不到 6%),因此值得关注。两个例外是钾和铬,在 DMSA 的 3 天内,它们平均每天额外损失 57% 和 88% 的 RDA。然而,由于每轮 DMSA 之间至少有 11 天,因此 2 周的有效损失要少得多。钾的血液测量显示,在研究过程中没有变化,因此儿童的身体似乎能够补偿钾的轻微损失。由于孩子们正在服用他们选择的多种维生素/矿物质补充剂(其中大部分包括铬),因此铬的流失可能不是问题。一般来说,我们的数据表明,使用 DMSA 的人应该服用铬补充剂,并多吃水果和蔬菜(钾,在非处方多种维生素/矿物质补充剂中不允许大量摄入钾)。 由于 DMSA 是口服的,并且只有大约 20% 通过口服吸收,因此留在消化道中的 80% 中的一些可能与食物中的必需矿物质结合,导致必需矿物质的吸收减少。未来的研究可以检查红细胞中必需矿物质的水平,以检查长期影响,尤其是对铬的影响。 谷胱甘肽DMSA 治疗对 RBC 谷胱甘肽的异常水平正常化有显着影响。在研究开始时,一些儿童的水平异常高,相关性分析表明,这部分是由于有毒金属水平较高而产生的产量增加。一些儿童的水平异常低,相关性分析表明,这部分是由于汞的存在,众所周知,汞会强烈抑制谷胱甘肽的产生。令人惊讶的是,单轮 DMSA 导致异常水平急剧正常化,效果持续至少 1.5 个月。接受谷胱甘肽或安慰剂化妆水的组的效果相同,因此效果似乎是由于 DMSA,而不是谷胱甘肽化妆水。DMSA 的效果可能部分归因于其抗氧化能力,但这种效果似乎不太可能持久。相反,DMSA 的作用似乎很可能是由于 RBC 中有毒金属的减少,使谷胱甘肽恢复到正常水平。由于只需要 1 轮即可使 RBC 谷胱甘肽正常化,并且由于效果持续至少 1.5 个月,因此额外的 DMSA 可能几乎没有额外的益处。由于谷胱甘肽在体内发挥着许多重要功能,谷胱甘肽的改善可能会导致整体功能的改善,这表明接受 1 轮或 7 轮 DMSA 的儿童在行为上会有类似的改善。表 15令人惊讶的是,在研究开始时,许多儿童的血小板水平升高。血小板计数是一种急性期反应物,升高被认为是身体某处炎症的迹象。血小板计数与肠道问题没有显著相关性,因此炎症似乎主要与肠道无关。更令人惊讶的是,1 轮 DMSA 导致大约一半病例的血小板计数正常化,并且效果似乎持续了至少几个月。 这表明自闭症儿童的一些炎症是由于有毒金属引起的,这些金属可以被 DMSA 去除。 有 1 例儿童的白细胞 (WBC) 计数开始接近参考范围的底部,并且在研究过程中上下波动,最终以略低于参考范围的水平结束,但没有中性粒细胞减少或淋巴细胞减少症。因此,尽管需要对 DMSA 对 WBC 的影响进行更多研究,但这里似乎并不是 t DMSA 对 WBC 的主要不利影响。 化学面板有一些报道称,DMSA 用于治疗儿童铅中毒时,6-10% 的人的肝酶会略微增加 (PDR 2008),这通常涉及连续 21 天的 DMSA 治疗,每日剂量与我们研究中使用的剂量相似。然而,我们发现 DMSA 对肝转氨酶 (AST 和 ALT) 没有显着影响,可能是因为我们一次只治疗 3 天,中间间隔 11 天。 对 DMSA 效果唯一可能的担忧是 7 轮组中甘油三酯水平可能增加。甘油三酯水平最好通过空腹抽血来测量,但我们不要求禁食以简化参与方案的便利性。因此,目前尚不清楚这个结果是与非空腹抽血相关的随机伪影,还是真正的效果 - 未来的研究应该通过空腹抽血来检查这一点。 我们还发现,许多儿童最初 BUN/肌酐比值升高,这通常是由于肌酐低。肌酐低可能是儿童肌肉质量低的迹象。BUN/肌酐升高的变化可以用基于尿重金属排泄的回归分析来部分解释。这表明升高部分是由于重金属的存在,尤其是锡、钨和锑。到研究结束时,BUN/肌酐比值有小幅改善,但改善无统计学意义。任何研究参与者的肾功能均无显著恶化。 总体而言,DMSA 似乎耐受性良好。 不良反应该研究的大多数参与者报告了他们孩子的整体改善。然而,在第 1 阶段,有一份报告称有轻微的不良反应(嗜睡、食欲下降),该家庭选择不继续进行第 2 阶段。此外,在第 2 阶段,4 名儿童因不良反应而退出,其中 2 名儿童正在服用 DMSA,2 名儿童正在服用安慰剂。还有 2 名服用 DMSA 的儿童因金属尿排泄量低而提前结束研究,并且他们的一些症状有所恶化;1 例有中度睡眠问题,1 例有中度睡眠问题和发脾气增加。这些问题通常是暂时的,在停止治疗后得到解决。平均而言,根据父母总体印象,发脾气行为几乎没有变化(略有改善),睡眠和多动症略有恶化,因此这些症状应该在未来的治疗研究中记录下来,并可能表明 DMSA 可能引起的暂时性副作用。 请注意,治疗 3 天后停药 11 天的治疗方案远低于医师案头参考中推荐的中度/重度铅中毒(连续治疗 21 天),因此预计本研究中使用的治疗方案将比 21 天的治疗方案具有更少的副作用治疗方案。总体而言,本研究中的 DMSA 治疗似乎相对安全,只有少数不良反应报告通常是暂时的,严重程度为轻度或中度。 病历“吃/舔油漆”和异食癖与自闭症的严重程度之间存在非常高的相关性(SAS 高达 r = 0.63)。“吃/舔油漆”和异食癖与某些金属(尤其是铅、锡、铊、锑和钨)的尿液排泄密切相关,这表明异食癖可能是有毒金属的重要来源,占儿童接触这些金属的一半。这可能是恶性循环的一部分,自闭症恶化会导致包括异食癖在内的异常行为,进而导致有毒金属的消耗增加和症状恶化。 研究的局限性1) 第 1 阶段的最初 3 天 DMSA 旨在作为第 2 阶段的筛选,但发现第一轮 DMSA 在显着改善谷胱甘肽和使血小板水平正常化(炎症标志物)方面具有很大的有益作用。因此,本研究最好解释为 1 轮与 7 轮 DMSA 的比较。未来对 1 轮与 0 轮的研究会很有趣。 2) 在第 2 阶段结束时,80% 的儿童仍在排泄大量的铅和其他有毒金属。因此,似乎大多数儿童需要更长时间的 DMSA 试验以降低他们的有毒金属水平。 3) 大多数金属与其他金属具有一个或多个相关性,因此在进行回归分析时很难区分一种金属与另一种金属的影响。 4) 未进行血浆半胱氨酸水平测量;由于每个 DMSA 分子通常通过与 2 个半胱氨酸分子结合的尿液排泄,因此 DMSA 治疗可能会降低半胱氨酸水平。然而,由于半胱氨酸是谷胱甘肽的前体,并且谷胱甘肽水平在 1 轮 DMSA 后恢复正常,这可能不是问题。 5) 这项研究对于第 1 阶段来说足够大,对于第 2 阶段来说也足够大,因为可以将 1 轮和 7 轮组结合起来进行自闭症严重程度评分变化的回归分析。然而,未来需要一项更大规模的研究才能进行真正的安慰剂对照、双盲研究。 6) 没有测量尿卟啉,尿卟啉是重金属毒性的标志物。在未来的研究中衡量这将非常有趣。 7) 对于涉及多重比较的统计分析,在确定哪些 p 值最显著时应小心。一般来说,对于多重比较,我们假设 p < 0.01 表明结果是显著的。
结论1) 在本研究中,剂量和频率的 DMSA 疗法是一种相对安全的方法,可以去除有毒金属,使谷胱甘肽正常化,并改善升高的血小板水平,从而可能减轻自闭症儿童的炎症。 2) DMSA 确实会导致服用后几天钾和铬的尿液流失显著增加,因此适度补充铬和钾(或增加水果和蔬菜的摄入量)可能会有所帮助。 3) 一轮 (3 天) DMSA 在改善血小板水平方面几乎与七轮 DMSA (DMSA 3 天,11 天无给药,重复 7 次) 一样有效。 4) 在 20% 的参与者中,3 轮 DMSA 足以降低有毒金属(主要是铅)的排泄,但 80% 的儿童在 7 轮后仍排泄高水平的有毒金属(主要是铅)。这表明,更长时间的治疗可能有助于减少 80% 儿童的有毒金属。
未来的研究应考虑更长的治疗期,以及使用其他螯合剂。使用尿卟啉进行金属毒性预筛查可能有用。
引用Ballatori N,Clarkson TW:谷胱甘肽和谷胱甘肽-金属复合物的胆汁分泌。Fundam Appl 毒理学。1985, 5 (5): 816-31.10.1016/0272-0590(85)90165-4. 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 yaL28Xhs1Sqtg%3D%3D]中国科学院[/url] 公共医学 谷歌学术 yaL28Xhs1Sqtg%3D%3D]中国科学院[/url] 公共医学 谷歌学术 Ballatori N,Clarkson TW:无机汞的胆汁分泌对谷胱甘肽胆道运输的依赖性。生化药理学。1984, 33 (7): 1093-8.10.1016/0006-2952(84)90519-7. 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 yaL2cXksV2ltb8%3D]中国科学院[/url] 公共医学 谷歌学术 yaL2cXksV2ltb8%3D]中国科学院[/url] 公共医学 谷歌学术 Rowland IR、Robinson RD、Doherty RA:饮食对甲基汞小鼠汞代谢和排泄的影响:肠道菌群的作用。Arch Env Health(拱门环境运行状况)。1984, 39: 401-408. 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 yaL2MXht1Krsbg%3D]中国科学院[/url] 谷歌学术 yaL2MXht1Krsbg%3D]中国科学院[/url] 谷歌学术 James SJ、Cutler P、Melnyk S、Jernigan S、Janak L、Gaylor DW、Neubrander JA:自闭症儿童氧化应激增加和甲基化能力受损的代谢生物标志物。Am J Clin Nutr.2004, 80 (6): 1611-7. [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 C%2BD2cXhtFShtbvJ]中国科学院[/url] 公共医学 谷歌学术 C%2BD2cXhtFShtbvJ]中国科学院[/url] 公共医学 谷歌学术 James SJ、Melnyk S、Jernigan S、Cleves MA、Halsted CH、Wong DH、Cutler P、Bock K、Boris M、Bradstreet JJ、Baker SM、Gaylor DW:代谢内表型和相关基因型与自闭症儿童的氧化应激有关。Am J Med Genet B 神经精神病学基因。2006, 141: 947-956. Audhya T:自闭症儿童的营养异常。自闭症一个会议在。2004 年 5 月,伊利诺伊州芝加哥 Konstantareas MM,Homatidis S:自闭症和正常儿童的耳部感染。J 自闭症 Dev Disord。1987, 17 (4): 585-94.10.1007/BF01486973。 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:STN:280 yaL1c%2FlvVOhsw%3D%3D]中国科学院[/url] 公共医学 谷歌学术 yaL1c%2FlvVOhsw%3D%3D]中国科学院[/url] 公共医学 谷歌学术 Adams JB、Holloway CE、Margolis M、George F:自闭症儿童的重金属暴露、发育里程碑和身体症状。秋季会议论文集。2003, 71-75.立即击败自闭症!2003 年 10 月 3 日至 5 日,俄勒冈州波特兰市召开的会议 Adams JB、Romdalvik J、Ramanujam VMS、Legator MS:自闭症儿童乳牙与对照组中的汞、铅和锌。J 毒理学环境健康。2007,A70:1046-1051。10.1080/15287390601172080. Adams JB, Romdalvik J, Levine KE, 胡 L-W:自闭症儿童与正常发育儿童第一次剪掉的婴儿头发中的汞。毒理学与环境化学.2008, 90 (4): 739-753.10.1080/02772240701699294. 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 C%2BD1cXht1OisrrL]中国科学院[/url] 谷歌学术 C%2BD1cXht1OisrrL]中国科学院[/url] 谷歌学术 Rowland IR、Davies M、Evans J:口服甲基氯化汞大鼠体内汞的组织含量:肠道菌群的影响。Arch Environ Health.1980, 35: 155-160. 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 yaL3cXkvV2ksL0%3D]中国科学院[/url] 公共医学 谷歌学术 yaL3cXkvV2ksL0%3D]中国科学院[/url] 公共医学 谷歌学术 Rowland IR、Grasso P、Davies MJ:人类肠道细菌对氯化汞的甲基化。体验。1975, 31: 1064-1065.10.1007/BF02326961. 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 yaE2MXls1Smt7c%3D]中国科学院[/url] 公共医学 谷歌学术 yaE2MXls1Smt7c%3D]中国科学院[/url] 公共医学 谷歌学术 Holmes AS、Blaxill MF、Haley BE:自闭症儿童第一次婴儿发型中的汞含量降低。国际毒理学杂志。2003, 22 (4): 277-285.10.1080/10915810305120. 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 C%2BD3sXmsV2htb4%3D]中国科学院[/url] 谷歌学术 C%2BD3sXmsV2htb4%3D]中国科学院[/url] 谷歌学术 Kern JK、Grannemann BD、Trivedi MH、Adams JB:自闭症中的巯基活性金属。J 毒理学环境健康 A. 2007, 70: 1-7.10.1080/15287390601188060. Ip P、Wong V、Ho M、Lee J、Wong W:自闭症谱系障碍儿童的汞暴露:病例对照研究。儿童神经学杂志。2004, 19: 431-434。勘误表 J Child Neurol. 2007 年 11 月;22 (11):1324 DeSoto MC,Hitlan RT:血液中的汞水平与自闭症的诊断有关:对重要数据集的重新分析。J 儿童神经病学。2007, 22: 1308-11.10.1177/0883073807307111. Adams JB、Holloway CE、George F、Quig D:自闭症儿童及其母亲头发中的有毒金属和必需矿物质。生物追踪 El Res. 2006, 110: 193-209。10.1385/BTER:110:3:193。 品 [url=https://bmcclinpharma.biomedcentral.com/articles/cas-redirect/1:CAS:528 C%2BD28XlvFCisL4%3D]中国科学院[/url] 谷歌学术 C%2BD28XlvFCisL4%3D]中国科学院[/url] 谷歌学术 Bradstreet J、Geier DA、Kartzinel JJ、Adams JB、Geier MR:自闭症谱系障碍儿童汞负担的病例对照研究。J Am Phys Surg. 2003, 8 (3): 76-79. Geier DA,Geier MR:硫柳汞对儿童神经发育障碍影响的评估。儿科康复。2003, 6: 97-102.10.1080/1363849031000139315. Geier DA,Geier MR:MMR 免疫接种和含硫柳汞儿童疫苗的汞剂量对自闭症人群患病率影响的比较评估。Med Sci Monit.2004, 10: 133-139. Geier DA,Geier MR:含硫柳汞疫苗后的神经发育障碍:简短交流。Exp Biol Med (梅伍德)。2004, 228: 660-664. Geier DA,Geier MR:含硫柳汞疫苗安全性的两阶段人群流行病学研究:后续分析。Med Sci Monit.2005 年 11 月:CR160-CR170。 Geier DA,Geier MR:对 1994 年至 2000 年在美国接种疫苗后神经发育障碍的荟萃分析流行病学评估。神经内分泌Lett.2006,27:401-413。 Geier DA,Geier MR:自闭症中卟啉的前瞻性评估:重金属暴露的潜在标志物。神经毒理学研究 2006, 10: 57-64。10.1007/BF03033334。 Geier DA,Geier MR:从儿童疫苗中去除硫柳汞后美国神经发育障碍下降趋势的评估。Med Sci Monit.2006, 12: CR231-CR239. Geier DA,Geier MR:与美国 DTPH 疫苗相比,报告了 DTP 和 Hib 疫苗后硫柳汞对神经发育障碍影响的评估。J 毒理醇环境健康。2006,A69:1481-91。10.1080/15287390500364556. Geier DA,Geier MR:去除含硫柳汞疫苗后神经发育障碍的早期下降趋势。J Am Phys Surg. 2006, 11: 8-13. Geier MR,Geier DA:含硫柳汞疫苗后的神经发育障碍:简短的交流。实验生物学医学 2003, 228: 660-664。 Geier MR,Geier DA:硫柳汞在美国儿童疫苗、神经发育障碍和心脏病中的应用。J Am Phys Surg. 2003, 8: 6-11. Andrews N、Miller E、Grant A、Stowe J、Osborne V、Taylor B:婴儿和发育障碍的硫柳汞暴露:英国的一项回顾性队列研究不支持因果关系。小儿科。2004, 114 (3): 584-91.10.1542/peds.2003-1177-L. Fombonne E、Zakarian R、Bennett A、Meng L、McLean-Heywood D:加拿大魁北克省蒙特利尔普遍存在的发育障碍:患病率和与免疫接种的联系。小儿科。2006, 118 (1): e139-50.10.1542/peds.2005-2993。 Hviid A、Stellfeld M、Wohlfahrt J、Melbye M:含硫柳汞疫苗与自闭症之间的关联。美国医学会。2003, 290 (13): 1763-6.10.1001/jama.290.13.1763. Madsen KM、Lauritsen MB、Pedersen CB、Thorsen P、Plesner AM、Andersen PH、Mortensen PB:硫柳汞和自闭症的发生:来自丹麦人口数据的负面生态证据。小儿科。2003, 112 (3 Pt 1): 604-6.10.1542/peds.112.3.604 的。 Stehr-Green P、Tull P、Stellfeld M、Mortenson PB、Simpson D:自闭症和含硫柳汞的疫苗:缺乏一致的关联证据。美国预防医学杂志 2003, 25 (2): 101-6.10.1016/S0749-3797(03)00113-2。 Verstraeten T、Davis RL、DeStefano F、Lieu TA、Rhodes PH、Black SB、Shinefield H、Chen RT:含硫柳汞疫苗的安全性:计算机化健康维护组织数据库的两阶段研究。小儿科。2003, 112 (5): 1039-48. Bernard S、Enayati A、Roger H、Binstock T:自闭症:一种新型的汞中毒。Med 假设。2001, 56 (4): 462-471.10.1054/mehy.2000.1281. Nelson KB,Bauman ML:硫柳汞和自闭症?小儿科。2003, 111 (3): 674-9.10.1542/peds.111.3.674. 有毒物质和疾病登记处:汞毒理学概况。第 1.6 节.1999 年,美国卫生与公众服务部 Nataf R、Skorupka C、Amet L、Lam A、Springbett A、Lathe R:儿童自闭症中的卟啉尿症:对环境毒性的影响。毒理学应用药理学。2006, 214: 99-108.10.1016/j.taap.2006.04.008. Geier DA,Geier MR:自闭症中卟啉的前瞻性评估:重金属暴露的潜在标志物。神经毒性研究。2006, 10: 57-64.10.1007/BF03033334。 Geier DA,Geier MR:自闭症谱系障碍中汞毒性生物标志物的前瞻性研究。J 毒理学与环境健康。2007, A70: 1723-30.10.1080/15287390701457712. Geier DA、Kern JK、Garver CR、Adams JB、Audhya T、Nataf R、Geier MR:自闭症环境毒性和易感性的生物标志物。神经科学杂志 2009, 280: 101-108.10.1016/j.jns.2008.08.021.Epub - 2008 年 9 月 24 日 Stangle DE、Smith DR、Beaudin SA、Strawderman MS、Levitsky DA、Strupp BJ:琥珀菌螯合剂可改善铅暴露大鼠的学习、注意力和唤醒调节,但在没有铅暴露的情况下会产生持久的认知障碍。环境健康观察。2007, 115 (2): 201-9.Epub 2006 年 10 月 30 日。 Stein J、Schettler T、Wallinga D、Valenti M:以危险的方式:对儿童发展的有毒威胁。J Dev Behav Pediatr.2002, 23 (1 增刊): S13-22. Adams JB、Baral M、Geis E、Mitchell J、Ingram J、Hensley A、Zappia I、Newmark S、Gehn E、Rubin RA、Mitchell K、Bradstreet J、El-Dahr JM:口服 DMSA 治疗自闭症谱系障碍儿童的安全性和有效性:B 部分 - 行为结果。BMC 临床药理学。2009, 9: 17-10.1186/1472-6904-9-17. Adams JB、Baral M、Geis E、Mitchell J、Ingram J、Hensley A、Zappia I、Newmark S、Gehn E、Rubin RA、Mitchell K、Bradstreet J、El-Dahr JM:自闭症的严重程度部分由有毒金属体负荷和红细胞谷胱甘肽水平解释。毒理学杂志。2009, 2009: 7-10.1155/2009/532640.文章 ID: 532640
出版前历史记录
确认首先,我们感谢许多自愿参与这项研究的自闭症家庭。我们感谢华莱士基金会和自闭症研究所对这项研究的财政支持。我们感谢 SCNM 的 Nellie Foster 在抽血方面的帮助。我们感谢 David Burk 在分析 CBC 和 ChemPanel 数据方面提供的帮助。我们感谢 Women's International Pharmacy 协助为每个孩子单独配制 DMSA。我们感谢 Spectrum Chemicals 提供 DMSA。我们感谢 Doctor's Data 和 Immunosciences 以更低的成本提供检测。我们感谢美国自闭症协会 - 大凤凰城分会和亚利桑那州发育障碍部门在宣传这项研究方面提供的帮助。
作者信息作者和单位通讯作者
其他信息:利益争夺作者声明他们没有利益争夺。 作者的贡献JBA 是该研究的主要组织者,进行了初步数据分析,并且是主要作者。他是该研究的官方联合首席研究员。MB 是大凤凰城地区的主治医生。他是官方首席研究员,并与 JBA 合作进行研究设计和研究批准。EG 是研究协调员和首席研究护士。JM 是协助 MB 的二级医生。JI 是大凤凰城地区的 ADOS 评估员。AH 是一名学习护士。IZ 是大图森地区的 ADOS 评估员。SN 是大图森地区的医生。EG 负责数据输入并帮助进行数据分析。RAR 是该研究的主要统计学家,并进行了回归分析。KM 是协助配制 DMSA 的药剂师。JB 是一名医生,担任该研究的顾问。JME 是一名医生,担任该研究的顾问。所有作者都阅读并批准了最终的手稿。
|